- La energía libre de Gibbs permite predecir si una reacción química será espontánea.
- Su fórmula ΔG = ΔH - TΔS relaciona entalpía, entropía y temperatura.
- El signo del resultado de ΔG indica si una reacción ocurre sin intervención externa.
- Es una herramienta clave en termodinámica y química para anticipar procesos sin experimentarlos.

¿Alguna vez te has preguntado por qué ciertas reacciones químicas ocurren por sí solas y otras necesitan ayuda externa? Ese misterio se resuelve gracias a un concepto fundamental en termodinámica: la energía libre de Gibbs. Este valor, a pesar de sonar complejo, nos ofrece una herramienta clave para entender mejor la espontaneidad de los procesos químicos y físicos dentro de un sistema.
En este artículo te vamos a explicar en detalle qué es la energía libre de Gibbs, por qué es importante, cómo se calcula y cómo puedes aplicarla incluso a nivel práctico. No solo entenderás la teoría, sino que te llevaremos paso a paso por ejemplos que te ayudarán a interiorizar este conocimiento tan útil tanto para estudiantes como para quienes apenas se adentran en el mundo de la química.
Índice
- 1 ¿Qué es la energía libre de Gibbs?
- 2 El significado de la variación de G (ΔG)
- 3 Interpretación de los signos de ΔG
- 4 Importancia del contexto en la espontaneidad
- 5 Conceptos básicos que debes conocer
- 6 Reacciones químicas y ΔG: ¿cómo saber si ocurren?
- 7 Ejemplo práctico de cálculo de ΔG
- 8 Otro ejemplo: disolución de nitrato de amonio en agua
- 9 Aplicaciones de la energía libre de Gibbs
- 10 Dependencia de la temperatura
- 11 Errores comunes y consejos prácticos
- 12 Otros recursos y herramientas
¿Qué es la energía libre de Gibbs?
La energía libre de Gibbs, conocida también como función de Gibbs o entalpía libre, es una magnitud termodinámica que relaciona la energía disponible en un sistema para realizar trabajo útil. Fue desarrollada por el físico y matemático estadounidense Josiah Willard Gibbs en el siglo XIX como parte de sus estudios sobre las funciones de estado termodinámicas.
Se expresa con la letra G y su fórmula general es: G = H – T·S
Donde:
- H es la entalpía: la cantidad total de energía que un sistema puede intercambiar con su entorno.
- T es la temperatura absoluta (en Kelvin).
- S es la entropía: una medida del desorden del sistema o de la energía no utilizable.
El significado de la variación de G (ΔG)
En una reacción química, el valor que nos interesa no es directamente G, sino su variación, representada por ΔG. Esta nos indica si una reacción es espontánea (se produce sin necesidad de energía externa) o no lo es.
La fórmula que se utiliza es: ΔG = ΔH – T·ΔS
Aquí, los valores indican el cambio en cada una de esas magnitudes durante la reacción.
Interpretación de los signos de ΔG
A partir de la fórmula, podemos saber si un proceso será espontáneo o no según el valor de ΔG:
- ΔG negativo: La reacción es espontánea tal como está formulada. Es lo que se conoce como proceso exergónico.
- ΔG positivo: La reacción no es espontánea en la dirección planteada; puede serlo si se invierte. Se le denomina endergónica.
- ΔG igual a 0: El sistema está en equilibrio; no hay cambio neto.
Importancia del contexto en la espontaneidad
Es fundamental tener en cuenta que tanto la entalpía como la entropía y la temperatura pueden variar. Esto significa que una misma reacción puede ser espontánea en unas condiciones y no en otras. Por ejemplo, una reacción endotérmica puede llegar a ocurrir espontáneamente si el aumento en entropía es suficientemente alto y/o si la temperatura es elevada.
Conceptos básicos que debes conocer
Para entender bien la energía libre de Gibbs, es necesario repasar algunos conceptos fundamentales de la termodinámica:
- Sistema termodinámico: Es la parte del universo que se está analizando. Puede ser abierto, cerrado o aislado dependiendo de si intercambia materia y energía.
- Entalpía (H): Representa la energía total que un sistema puede liberar o absorber. Incluye la energía interna y el trabajo realizado por presión y volumen.
- Entropía (S): Es una medida de cuán desordenado está un sistema. Cuanta más entropía, mayor desorden y menor capacidad para hacer trabajo útil.
- Temperatura (T): Es una magnitud física que indica el nivel de calor y afecta directamente a cómo interactúan entalpía y entropía.
Reacciones químicas y ΔG: ¿cómo saber si ocurren?
Gracias a ΔG, los científicos pueden predecir si una reacción química ocurrirá espontáneamente sin necesidad de realizarla experimentalmente. Esto ahorra recursos y tiempo en laboratorios.
Por ejemplo, si se quiere saber si una reacción necesita aporte externo de energía (como una chispa en una combustión), basta con realizar los cálculos usando la fórmula:
ΔG = ΔH – T·ΔS
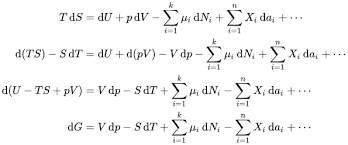
Ejemplo práctico de cálculo de ΔG
Veamos este ejemplo clásico: la formación de amoníaco (NH3) a partir de nitrógeno e hidrógeno:
N2(g) + 3H2(g) → 2NH3(g)
Supongamos las siguientes condiciones:
- T: 25ºC (298K)
- ΔH: -90kJ/mol
- ΔS: -200J/molK
Aplicamos la fórmula:
ΔG = -90kJ/mol – (298K)(-200J/molK)
ΔG = -90kJ/mol + 59600J/mol = 59510J/mol = 59.51kJ/mol
Como el resultado es positivo, la reacción no es espontánea a esa temperatura.
Otro ejemplo: disolución de nitrato de amonio en agua
NH4NO3(s) + H2O(l) → NH4+(aq) + NO3–(aq)
Condiciones:
- T: 25ºC (298K)
- ΔH: 28kJ/mol
- ΔG: -4.4kJ/mol
Para entender el proceso, podemos calcular la variación de entropía:
Reordenamos la fórmula:
ΔS = (ΔH – ΔG) / T = (28kJ/mol + 4.4kJ/mol) / 298K ≈ 0.11kJ/molK = 110J/molK
En este caso, aunque la reacción es endotérmica (absorbe calor), aumenta tanto la entropía que ΔG resulta negativo, haciendo que la reacción sea espontánea.
Aplicaciones de la energía libre de Gibbs
Este concepto no es solo teórico. Tiene implicaciones muy prácticas:
- Permite predecir reacciones químicas industriales o en laboratorio.
- Ayuda a entender procesos biológicos como la síntesis del ATP.
- Se utiliza en bioquímica, física, biología y más campos científicos.
Por ejemplo, en reacciones bioquímicas, conocer el ΔG permite saber si una célula puede efectuar cierta transformación sin gastar energía extra.
Dependencia de la temperatura
Un aspecto crucial es que una misma reacción puede cambiar su espontaneidad según la temperatura. Si T es alta, el término T·ΔS puede volverse más influyente que ΔH. Esto explica por qué algunas reacciones tienen lugar solo a ciertas temperaturas.
Por ejemplo, muchas reacciones endotérmicas solo son espontáneas a temperaturas elevadas debido a un incremento significativo en entropía.
Errores comunes y consejos prácticos
Es fácil cometer errores si no se usan unidades coherentes o si se olvida convertir la temperatura a Kelvin (muy importante). Además, recuerda que ΔS suele darse en J/mol·K y ΔH en kJ/mol, por lo que debes unificar las unidades antes de usar la fórmula.
Otros recursos y herramientas
Si quieres profundizar más en este tema, te recomendamos visitar el portal de Labster, donde ofrecen simulaciones educativas, o leer el artículo completo en ChemistryTalk que amplía con más ejemplos y ejercicios resueltos.
Todo sobre la entalpía: definición, fórmulas, aplicaciones y ejemplos
Comprender la energía libre de Gibbs permite anticipar el comportamiento de las reacciones químicas sin necesidad de ensayo y error. Es una herramienta indispensable no solo para la química, sino también para áreas como la bioquímica y la ingeniería. La relación entre entalpía, entropía y temperatura nos ofrece una visión global de los procesos energéticos que rigen el mundo físico. Entender bien cómo funciona ΔG y saber aplicarlo marca una diferencia clave en la interpretación de cualquier fenómeno termodinámico.
Todo sobre la entropía: significado, física, ejemplos y curiosidades



